
Werden Lösungen gemischt, entsteht naturgemäß eine Lösung neuer Konzentration. Wie die Konzentrationsverhältnisse nun aussehen, zeigt die folgende Grafik:

Im Prinzip liegen analoge Verhältnisse vor, wenn Lösung A nur mit Wasser verdünnt wird — dann fehlt der Anteil an Substanz b:
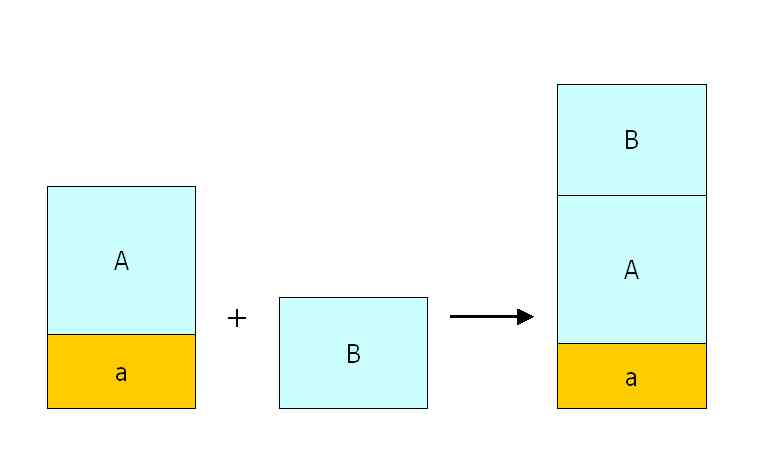
Rechentechnisch liegt hier ein besonders einfacher Fall vor, wenn man bedenkt, dass sich die Konzentrationsänderung reziprok zur Verdünnung verhält! Das heißt: auf die doppelte Masse verdünnt (2 ×) ⇒ halbe Konzentration (c = 1/2); auf das Zehnfache verdünnt (10 ×) ⇒ ein Zehntel der Konzentration (c = 1/10).
Vergleichbare Verhältnisse liegen auch vor, wenn zu Lösung A nur Festsubstanz zugegeben wird:
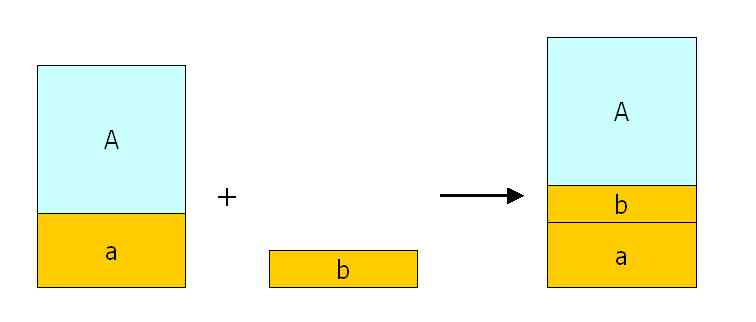
Daraus lassen sich durchaus Rechenbeispiele mit Praxisrelevanz ableiten, zum Beispiel:
Mehr um des Rechnens willen finden sich auch Rechenbeispiele der folgenden Art:
Wir können von folgenden Fakten ausgehen:
(a + A) + (b + B) + ... = (a + b + ... + A + B + C)
mA × wA + mB × wB + ... = mM × wM
mA: Gesamtmasse von Lösung A (= a + A); wA: Massenanteil des gelösten Stoffes = a/(a+A)
mB: Gesamtmasse von Lösung B (= b + B); wB: Massenanteil des gelösten Stoffes = b/(b+B)
mM: Gesamtmasse der Mischung (= a + b + ... + A + B + ...); wM: Massenanteil der gelösten Stoffe in Summe = a + b + .../(a + b + ... + A + B + ...)
Der Massenanteil x 100 gibt direkt die Massenprozent wieder. Das heißt z. B.: wA = 1,0 → c = 100%; wX = 0,4 → c = 40%; wZ = 0,105 → c = 10,5%.
Die Pünktchen zeigen an, dass die Mischungsgleichung natürlich auch für Mischungen von drei, vier oder mehr Lösungen gilt.
Der eigentliche Rechengang folgt der Auflösung einer Gleichung mit einer Unbekannten (bzw. zwei Unbekannten — die schwierigeren Fälle).
100 g einer 5%-igen Lösung und 80 g einer 10%-igen Lösung werden gemischt. Wie groß ist die Zielkonzentration (in %)?
Überlegen Sie selbst den Rechengang, bevor Sie nachsehen (Lösung der Rechnung). Wie kann man das Ergebnis auf einfache Weise überprüfen?
100 g einer 3%-igen Kochsalzlösung sind mit Kochsalz auf eine Endkonzentration von 5% zu bringen. Wieviel g Kochsalz sind hinzuzufügen?
Überlegen Sie selbst den Rechengang, bevor Sie nachsehen (Lösung der Rechnung). Wie kann man das Ergebnis auf einfache Weise überprüfen?
Das Mischungskreuz stellt eine Schnellrechenmethode dar, die für folgende Praxis-Fälle besonders geeignet ist:
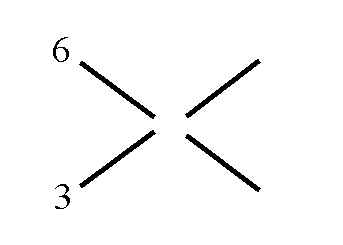
Wie man vorgeht, soll an einem Beispiel gezeigt werden: Aus einer 6%-igen und einer 3%-igen Lösung sollen 90 g einer 5%igen hergestellt werden. Wieviel g benötigt man jeweils von den Ausgangslösungen?
1. Man zeichnet ein Kreuz und setzt links oben und links unten die Ausgangskonzentrationen ein:
2. In die Mitte des Kreuzes kommt die Endkonzentration:
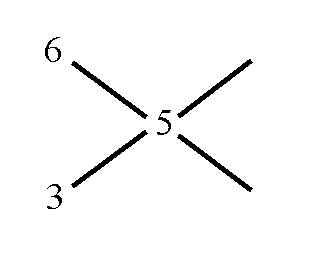
3. In Diagonalrichtung wird nun subtrahiert, wobei jeweils der kleinere vom größeren Wert abgezogen wird — es gibt somit keine negativen Ergebnisse! Das Ergebnis der Subtraktion(en) wird in Verlängerung der Kreuzachsen angeschrieben:
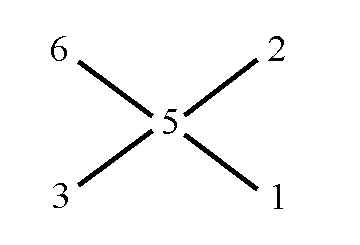
4. Nun kann man direkt das Ergebnis ablesen: Rechts oben sieht man den (erforderlichen) Anteil der oberen = 6%-igen Lösung, recht unten den Anteil der unteren = 3%-igen Lösung: Man muss also die Lösungen im Massen-Verhältnis 2 : 1 mischen.
5. Da 90 g Endmischung herzustellen sind, muss man 90 * 2 / 3 = 60 g der 6%-igen Lösung und 90 * 1 / 3 = 30 g der 3%-igen Lösung mischen.
Verdünnen über das Mischungskreuz - kaum schwieriger:
Versuchen Sie es selbst: 100 g einer 5%-igen Lösung sollen aus einer 8%-igen Lösung durch Verdünnung hergestellt werden. Die Frage wird wohl sein: Wieviel g der 8%-igen Lösung sowie wieviel g Wasser werden benötigt? Lösen Sie das Beispiel selbst, bevor Sie nachsehen (Rechengang).
Die Dichte muss bekannt sein, wenn statt g-Angaben mL-Angaben gemacht werden (Volumen statt Masse). Näheres zur "Dichteproblematik" findet sich im nächsten Kapitel...
![]() Der Einfachheit halber ist bei vielen Rechenbeispielen keine Dichte angegeben, diese kann dann mit 1 angenommen werden. Eigentlich kann man nur bei stark verdünnten wässrigen Lösungen von einer Dichte ρ = 1,000 ausgehen. Näheres hierzu — was bedeutet "stark verdünnt"? — findet sich später im Kapitel "Molarität"...
Der Einfachheit halber ist bei vielen Rechenbeispielen keine Dichte angegeben, diese kann dann mit 1 angenommen werden. Eigentlich kann man nur bei stark verdünnten wässrigen Lösungen von einer Dichte ρ = 1,000 ausgehen. Näheres hierzu — was bedeutet "stark verdünnt"? — findet sich später im Kapitel "Molarität"...
Jetzt sind Sie an der Reihe. Es sind einige Rechenbeispiele vorbereitet:
M. Kratzel (2007-03-05)