Eine 1-molare Säure (oder Base, ...) - 1 M Säure/Base - enthält 1 Mol/L oder 1 mMol/mL oder 1 µMol/µL
Eine 0,1-molare Säure (oder Base, ...) - 0,1 M Säure/Base - enthält 0,1 Mol/L oder 0,1 mMol/mL oder 0,1 µMol/µL
Wozu braucht man die Molarität? Ein kurzer Ausflug: Reaktionspartner reagieren in chemischen Reaktionen im definierten Mengenverhältnis miteinander. Dieses Verhältnis lässt sich problemlos aus der jeweiligen Reaktionsgleichung ablesen. Man spricht von der Stöchiometrie chemischer Reaktionen.
Zum Beispiel: Eisenionen werden mit Lauge als Eisenhydroxid ausgefällt:Fe3+ + 3 OH– ⇒ Fe(OH)3
Um 1,000.000 Eisen3+-Ionen vollständig in Eisenhydroxid überzuführen, brauche ich exakt 3 x 1,000.000 = 3,000.000 Hydroxylionen. Würde ich weniger Hydroxylionen anbieten, wäre die Fällung nicht vollständig — es würden freie Eisenionen übrig bleiben —, werden mehr Hydroxylionen verwendet, liegen freie Hydroxylionen neben Eisenhydroxid vor.
Weiß ich nun die Menge der vorliegenden Eisenionen in Lösung, kann ich die benötigte Menge an Hydroxylionen exakt vorhersagen und damit die Zugabe von beispielsweise Natronlauge als "Hydroxylionen-Lieferant" genau dosieren.
Das Arbeiten mit Molekülzahlen wäre allerdings extrem unhandlich — wir wären nicht im Bereich von Millionen sondern im Bereich von Quadrillionen — und dadurch enorm fehlerbelastet. Hier ist der Molbegriff ein feiner Ausweg, denn durch das Mol kommen wir in vernünftige, praktikable Größenordnungen.
Die Loschmidt-Zahl (oder Avogadro-Konstante) sagt uns, dass 1 Mol eines Stoffes die unvorstellbare Zahl von 6,022 × 1023 Molekülen enthält. Das bedeutet weiters, dass 1 Mol des Stoffes A exakt gleich viele Moleküle enthält wie 1 Mol des Stoffes B.
Ich weiß nicht, ob Sie den Begriff der Maßzahl kennen, darunter versteht man Begriffe, mit denen eine bestimmte Stückzahl ausgedrückt wird. Ein bekanntes, noch heute verwendetes Beispiel ist das Dutzend, das 12 Stück bedeutet ("Ein Dutzend Eier..."), eine veraltete Maßzahl das Schock, das 60 Stück entspricht. Und so kann man das Mol eigentlich auch als Maßzahl betrachten, als die Maßzahl der Chemie, gleich bedeutend mit 6,022 × 1023 Stück.
1 Mol ist aber auch das Molekulargewicht, in g ausgedrückt. Bei isolierten Atomen ist 1 Mol das Atomgewicht, in g ausgedrückt.
Um das Molekulargewicht einer Verbindung zu berechnen, benötigen wir die Summenformel, die die Elementarzusammensetzung wiedergibt - Beispiel: C2H6O (Ethanol):
Wieviel g sind 1,2 Mol Li-Atome?
Welche Masse haben 2,5 Mol der Verbindung mit der Summenformel C4H11O ?
Wieviel mMol entsprechen 757 mg Benzylalkohol (Summenformel: C7H8O) ?
Vorerst ein einfaches Übungsbeispiel zur Berechnung von Molekulargewichten und Molmengen...
Und nun die anspruchsvollere Variante. Beachten Sie, dass teilweise die Formeln die Struktur wiedergeben und günstigerweise zuerst in die "richtige" Summenformel umzurechnen sind. Werfen Sie auch ein prüfendes Auge auf die Einheiten!
In unmittelbarem Zusammenhang mit dem Molekulargewicht steht auch die Berechnung der Elementarzusammensetzung: Wieviel Massenprozent der einzelnen Atomtypen sind in der betrachteten Verbindung vorhanden? So kann durch geeignete analytische Methoden (z.B. die Elementaranalyse) überprüft werden, ob der berechnete Wert mit dem gefundenen Wert übereinstimmt.
Beispiel: Berechne die Elementarzusammensetzung der Verbindung CH3COONa . 5 H2O
Hier handelt es sich um Natriumacetat, das 5 Mol Kristallwasser (pro Mol Salz) enthält. Das Kristallwasser muss natürlich in der Elementarzusammensetzung berücksichtigt werden. Die Formel versucht die Struktur wiederzugeben, zur Ermittlung der "richtigen" Summenformel werden die Atomzahlen jeweils summiert:
Der Anteil der einzelnen Elemente wird üblicherweise in Massenprozent (= Massenanteil × 100) ausgedrückt:
Wie lässt sich das Ergebnis auf einfache Weise überprüfen? Hier ist die Antwort.
Jetzt sind Sie an der Reihe:
Wenn man eine Lösung bereitet, die definierte Molmengen einer Substanz pro definiertes Volumen enthält, lässt sich sehr einfach eine exakte Reagenszugabe erreichen. Ich benötige beispielsweise exakt 3 mMol Salzsäure für eine chemische Reaktion (siehe Stöchiometrie, ganz oben). Zur Verfügung steht eine 1-molare Salzsäure (diese enthält definitionsgemäß 1 Mol Salzsäure pro Liter (!) Lösung; ). Wieviel mL dieser Lösung muss ich abmessen? Hier ist die Antwort zur Überprüfung.
1-molare Salzsäure = 1 M Salzsäure = enthält 1 Mol Salzsäure pro Liter
![]() Über die folgenden Verhältnisse sollte man sich im Klaren sein - ohne lange nachdenken zu müssen:
Über die folgenden Verhältnisse sollte man sich im Klaren sein - ohne lange nachdenken zu müssen:
Eine 1-molare Säure (oder Base, ...) - 1 M Säure/Base - enthält 1 Mol/L oder 1 mMol/mL oder 1 µMol/µL
Eine 0,1-molare Säure (oder Base, ...) - 0,1 M Säure/Base - enthält 0,1 Mol/L oder 0,1 mMol/mL oder 0,1 µMol/µL
Die Molarität ist immer auf 1 Liter, also das Volumen (!), bezogen. Die zu der Einheit Mol zugehörige physikalische Größe bezeichnet man als Stoffmenge. Daher ist Molarität = Stoffmengenkonzentration.
Auch hier sollte man sich bemühen ein "Gefühl für die Molarität" zu entwickeln. Zum Training eine Schätzaufgabe:
Und eine Rechenaufgabe:
Will man über die Masse rechnen (beispielsweise zur Berechnung der Konzentration in Massenprozent), muss man die Dichte der Lösung wissen — es ergibt sich die gleiche Problematik, wie im Kapitel 5: Volumprozent beschrieben. Die Dichte der Lösung muss somit für die Berechnung angegeben sein, oder man muss Umrechnungstabellen bemühen (Beispiel: Umrechnungstabelle Dichte / Massenprozent / Volumprozent für Salzsäure).
Konzentrationsangaben können auf vielfältige Weise erfolgen:
Man sollte daher in der Lage sein, eine Konzentrationsangabe in die andere umzurechnen. Es werden vor allem gebraucht:
Zur Umrechnung Molarität <-> Massenprozent finden sich hier einige Übungsbeispiele:
Wenn die Dichte der Lösung(en) ρ = 1 ist, entspricht die Masse dem Volumen (und umgekehrt). Man erspart sich dann natürlich die Umrechnung Masse <-> Volumen. Dann lassen sich Mischungen molarer Lösungen so einfach rechnen wie im Kapitel 4 gezeigt.
![]() Bei wässrigen Lösungen, deren Stoffmengenkonzentration < 0,1 Mol/L ist, kann man von einer Dichte ρ = 1,000 ausgehen — der Fehler ist <1%!.
Bei wässrigen Lösungen, deren Stoffmengenkonzentration < 0,1 Mol/L ist, kann man von einer Dichte ρ = 1,000 ausgehen — der Fehler ist <1%!.
Beispiel 1: Berechnen Sie die Konzentration einer Lösung (in Mol/L), die durch Mischen von 200 mL 0,1 M Salzsäure und 50 mL 0,02 M Salzsäure bereitet wurde.
Die Dichte aller beteiligten Lösungen wird mit ρ = 1,000 angenommen. Das ist legitim, da die Lösungen verdünnt sind (< 0,1 M) und keine Dichten angegeben sind. Das kann als vorsichtiger Hinweis gedeutet werden, dass von einer Dichte ρ = 1,000 ausgegangen werden kann.
Somit gilt: Masse = Volumen, und wir können die Mischungsgleichung verwenden, indem wir
VA × cA + VB × cB + ... = VM × cM
Das bedeutet:
cM = 200 × 0,1 + 50 × 0,02 / (200 + 50)
cM = 21 / 250 = 0,084 Mol/L
Wie lässt sich das Ergebnis auf einfache Weise überprüfen? Hier ist die Antwort...
Beispiel 2: In welchem Verhältnis sind 0,1-molare und 0,04-molare Kalilauge zu mischen, um eine 0,05-molare Lösung zu erhalten?
Hier lässt sich das Mischungskreuz verwenden, statt der Massenprozent werden die Stoffmengenkonzentrationen eingesetzt:
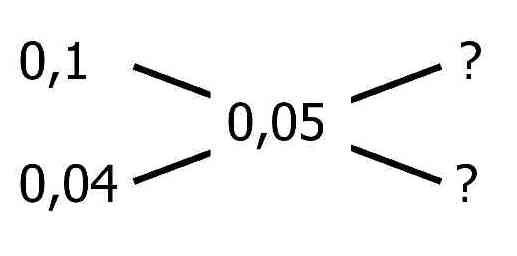
Es werden die Differenzen gebildet:

Daraus ergibt sich, dass die 0,1-molare und die 0,04-molare Lösung im Verhältnis 0,01 : 0,05 = 1 : 5 zu mischen sind.
Achtung: Wenn die Dichte ungleich 1 ist, bleibt uns nichts anderes übrig als wieder "über die Massenschiene" zu rechnen. Das heißt: Die Dichten der einzelnen Lösungen müssen bekannt sein, um das Beispiel lösen zu können.
Einige Rechenbeispiele für "molare Mischungen":
Und zum krönenden Abschluss das Komplettpaket: Molare Lösungen, die Umrechnung Massenprozent <-> Molarität sowie diverse Mischungsaufgaben:
M. Kratzel (2007-10-20)